
Un microbiote intestinal sain : une protection optimale dès le premier jour
Le microbiote intestinal en quelques mots
Le nombre de microorganismes vivants dans l’organisme humain est énorme, et est estimé entre 1012 et 1015 de cellules bactériennes. Ces bactéries sont environ deux à dix fois plus nombreuses que les cellules somatiques humaines. Autrement dit, seulement 10% de nos cellules sont humaines et 90% sont des bactéries.
Leur nombre exact est difficile à déterminer, cependant, des études récentes semblent clairement indiquer qu'il n'existe pas de région parfaitement stérile dans notre corps.
La concentration la plus importante de bactéries (un peu moins de 99 %) se trouve dans notre intestin. Il est donc vital qu’un nourrisson se constitue une flore intestinale saine dès le premier jour car plus de 80% des cellules immunocompétentes se trouvent dans l’intestin.
Notre système immunitaire et le microbiote intestinal travaillent ainsi en étroite collaboration. Ces microorganismes sont essentiels, surtout au début de la vie, car ils "entraînent" le système immunitaire encore immature du nourrisson.
Une colonisation bactérienne adéquate de l’intestin est indispensable pour chasser les pathogènes étrangers. Ces micro-organismes produisent également de nombreuses substances qui affectent directement l'environnement intestinal, et donc le métabolisme dans son ensemble. Un bon équilibre bactérien est donc primordial pour la santé des tout-petits, comme des plus grands.
La colonisation initiale de l’organisme du nourrisson
Pendant longtemps, on a supposé que la naissance était synonyme du début de la colonisation de l’organisme du nourrisson par des bactéries. Des recherches plus récentes suggèrent toutefois que le premier contact avec les bactéries a déjà lieu dans l'utérus.
Aujourd’hui, il est établi que le nourrisson se voit inoculer la flore microbienne de sa mère (vaginale et rectale), lors d’une naissance par voie basse. Ces microbes se retrouveront ainsi plus tard dans les intestins du nourrisson.
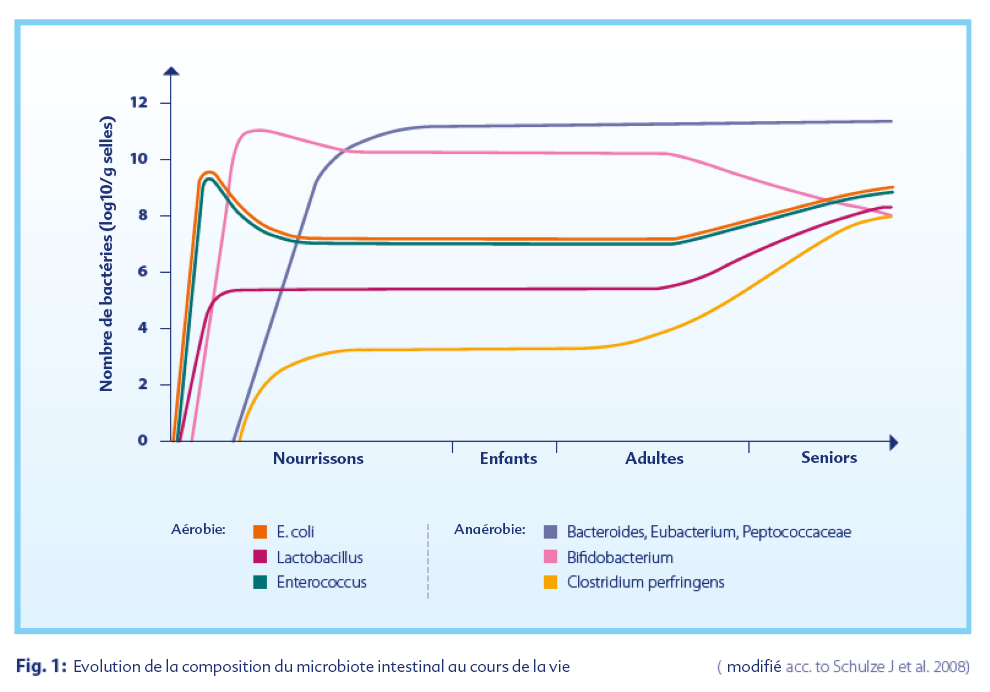
Au fil du temps, le microbiote va subir des modifications. Bien que les détails de ces évolutions ne soient pas encore complètement compris, on suppose aujourd'hui que cette colonisation suit un schéma récurrent :
• Une première colonisation par des micro-organismes anaérobies facultatifs. Parmi ces colonisateurs primaires de l'intestin, on retrouve des espèces d’entérobactéries, des lactobacilles (notamment L. fermentum, L. acidophilus et L. salivarius), et plusieurs entérocoques et staphylocoques (Bischoff SC 2009).
• Ces bactéries qui le tolèrent, vont peu à peu épuiser l'oxygène présent dans l'intestin et former un environnement propice au développement d’un second genre, les micro-organismes strictement anaérobies, dont les bactéroïdes et les bifidobactéries sont des représentants importants.
Au cours de la colonisation, les bactéries anaérobies représentent de loin le plus grand nombre de bactéries dans l'intestin. Cela ne signifie pas pour autant qu'elles sont les plus essentielles. En fin de compte, ce qui importe pour un microbiote intestinal "sain", c’est la synergie entre plusieurs microorganismes.
Le moment où la composition intestinale du futur adulte est stabilisée est encore débattu dans la communauté scientifique. On pense actuellement que cela se produit entre l'âge de deux et cinq ans (Rodríguez JM et al.2015). Le microbiote intestinal ne change alors pratiquement pas jusqu'à la fin de la vie.
Un microbiote intestinal sain, essentiel pour le système immunitaire
Au moment de sa naissance, de nombreux systèmes et organes de l’enfant sont encore immatures. Cela vaut également pour le système immunitaire, qui doit encore être "formé" afin d'atteindre son plein potentiel.
Cette tâche est prise en charge par le microbiote intestinal qui, par le biais de divers mécanismes, va agir directement contre les microorganismes étrangers et aider ainsi à prévenir les infections.
Les bactéries "positives" présentes dans l'intestin forment une sorte de barrière naturelle contre les microorganismes étrangers – elles bloquent les récepteurs des cellules de l'épithélium intestinal, les rendant inaccessibles aux agents pathogènes.
Elles produisent également des substances qui ont un effet bactériostatique et/ou bactéricide. Certaines souches, comme les lactobacilles, produisent de l'acide lactique qui abaisse la valeur du pH dans l'intestin, créant un environnement hostile pour de nombreux agents pathogènes.
Tout aussi importante que leur action directe contre les agents pathogènes, est la modulation du système immunitaire par les bactéries intestinales.
Ces dernières favorisent en effet la maturation du système lymphatique intestinal (GALT) et veillent à ce que les cellules immunitaires de l'intestin se multiplient en nombre et varient en nature.
De manière très importante, elles favorisent le développement de la tolérance du système immunitaire pour les bactéries commensales - les "bonnes" bactéries sont tolérées tandis que les "mauvaises" sont combattues.
Les chercheurs s'accordent aujourd’hui à dire qu'il convient d'accorder une attention particulière à un microbiote intestinal en bonne santé et se développant de manière appropriée, car il joue un rôle important dans la maturation du système immunitaire et la protection contre les infections.
Il est par ailleurs de plus en plus évident que la dysbiose, un déséquilibre du microbiote intestinal, peut avoir un impact négatif sur la santé à long terme. Des risques plus élevés d'obésité, d'allergies, de diabète, de troubles intestinaux, d'infections et même de troubles anxieux et de dépression ont tous été étudiés (Collado MC et al. 2012 ; Houghteling PD, Walker WA 2015).
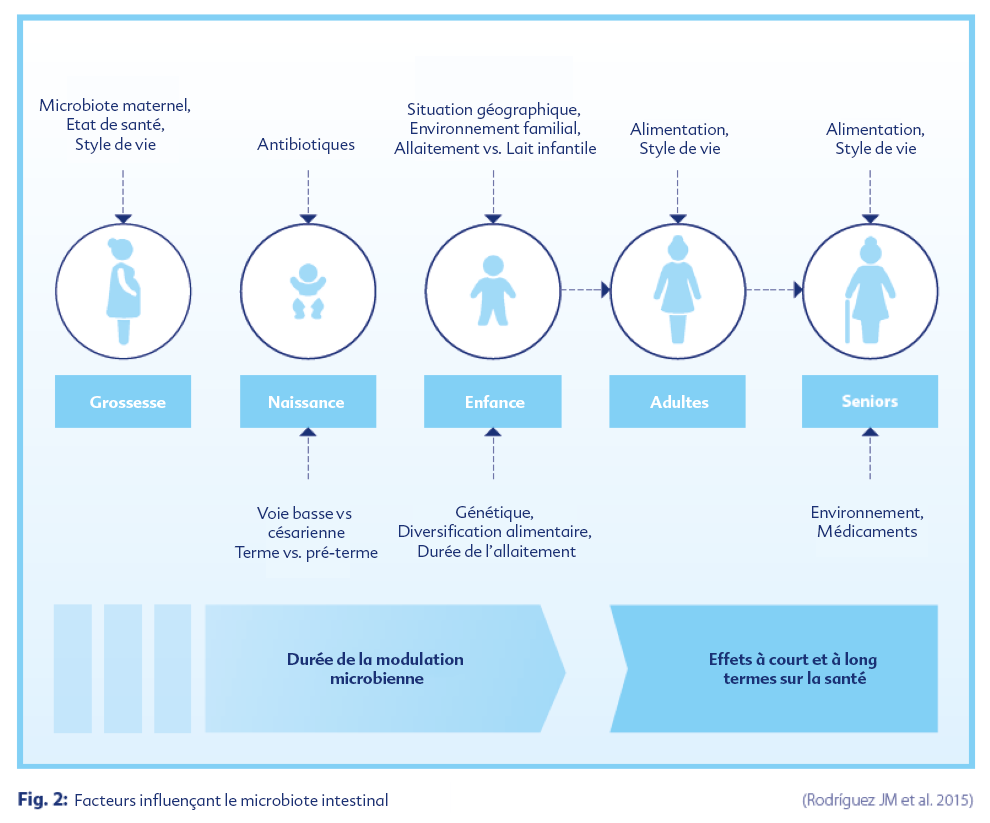
Quels sont les facteurs qui affectent le microbiote intestinal ?
Les facteurs d'influence précoces sont plus particulièrement à même d’avoir un impact sur le développement du microbiote intestinal de l’enfant :
• Type d'accouchement (par voie basse ou césarienne)
• Nutrition (allaitement ou lait infantile)
• Composition du lait infantile (standard, prébiotiques, probiotiques ou symbiotique)
Dès la grossesse, le microbiote maternel, l'état de santé et le mode de vie de la mère peuvent aussi influencer le microbiote transmis à l’enfant.
D’autres facteurs environnementaux tels que la présence de frères et sœurs au sein du foyer, le temps passé chez une nourrice ou en crèche, la prise de médicaments (antibiotiques) par la mère, ou encore le contact avec des animaux domestiques ont également une influence.
Pro-, pré- et symbiotiques - quelle influence sur le microbiote intestinal ?
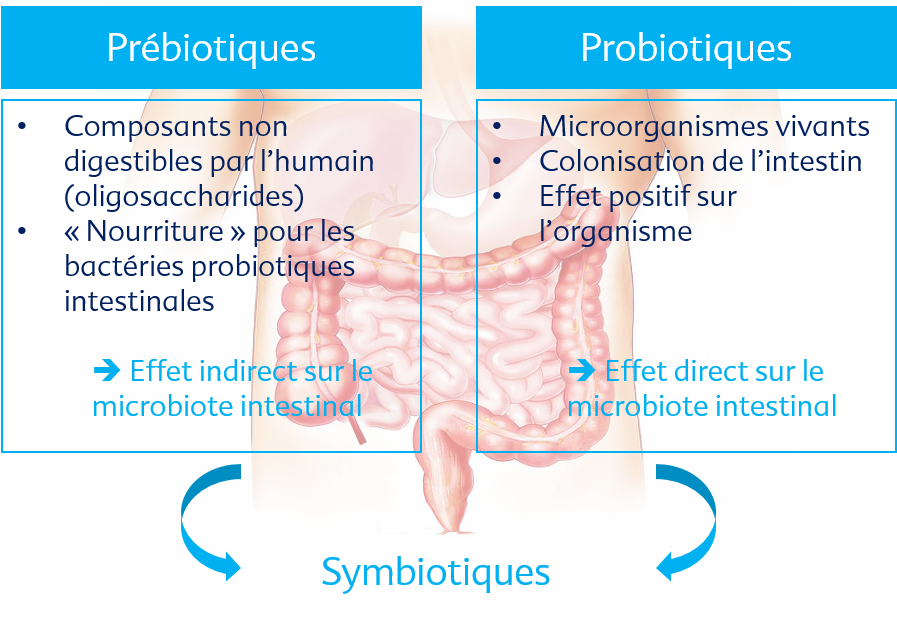
Les probiotiques et pré-biotiques, et surtout la combinaison de ceux-ci, peuvent influencer positivement le microbiote intestinal endogène.
Les probiotiques sont des micro-organismes vivants, non pathogènes, qui - lorsqu'ils sont administrés en nombre suffisant - ont un effet préventif ou thérapeutique sur l’organisme. Autrement dit, ils fournissent un bénéfice pour la santé (FAO/OMS 2001).
Les bactéries lactiques font partie des probiotiques les plus connus, et plus particulièrement certaines souches de lactobacilles et de bifidus.
Les prébiotiques sont des substrats spéciaux qui ne peuvent être ni découpés par des enzymes, ni absorbés dans la partie supérieure du tube digestif. Ils atteignent le côlon sous une forme non digérée, où ils servent de substrat pour la fermentation bactérienne et stimulent la reproduction de bactéries intestinales non pathogènes (Gibson GR, Roberfroid MD 1995).
Ce processus accélère la croissance des « bonnes » bactéries, dont la présence et la croissance permettent aux agents potentiellement pathogènes de se déposer dans une moindre mesure.
Les galacto-oligosaccharides, les fructo-oligosaccharides et l'inuline sont des exemples de substances prébiotiques actives.
Si un aliment contient à la fois des probiotiques et des prébiotiques, la combinaison est appelée symbiotique (Bischoff SC 2009). C’est le cas par exemple du lait maternel.
Influence du lait maternel sur le microbiote intestinal du nourrisson
L'alimentation de l'enfant est un facteur majeur d’influence de la composition et la santé du microbiote intestinal.
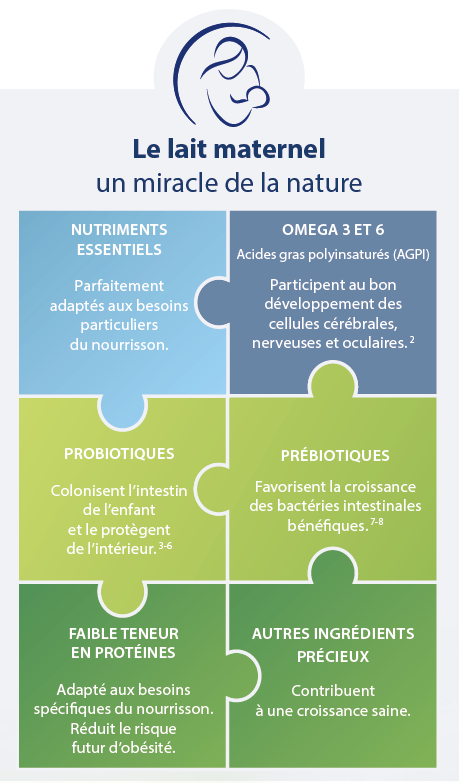
En cela, le lait maternel peut être considéré comme LA référence, car il contient, entre autres, des bactéries probiotiques aux effets positifs et des oligosaccharides aux propriétés prébiotiques. Comme le lait maternel combine les deux composants (pré et probiotiques), il est également considéré comme un aliment symbiotique naturel.
Le lait maternel n’est pas stérile
Le lait maternel a longtemps été considéré comme stérile. Mais récemment, il a été démontré que le lait maternel contenait des bactéries qui se transmettent au bébé, notamment via l'allaitement (Martín R et al. 2003 ; Heikkila MP et al. 2003).
Quelque 200 types différents de bactéries du lait maternel (environ 50 genres) ont ainsi déjà pu être identifiés. De grandes différences régionales et locales sont toutefois constatées, sans compter la diversité bactérienne individuelle de chaque femme (Sinkiewicz G et al. 2008).
De toutes les bactéries identifiées dans le lait maternel, les lactobacilles sont celles qui attirent le plus l'attention en raison de leur le potentiel probiotique.
Dans le cadre d'un processus de sélection complet, trois souches bactériennes du groupe des lactobacilles avec les propriétés probiotiques ont été isolées à partir de 1 500 cultures de lactobacilles dans le lait maternel : L. gasseri CECT5714, L. salivarius CECT5713 et L. fermentum CECT5716 (Martín et al. 2003).
De nombreuses études précliniques et cliniques ont été entreprises sur ces bactéries afin de prouver leur sécurité et leur efficacité (Lara-Villoslada F et al. 2007).
Les laits infantiles HiPP COMBIOTIC contiennent la souche probiotique L. fermentum CECT5716.
Consultez les résultats de l'étude
Références
2. Koletzko B et al. AJCN 2020; 111: 10–16.
3. Martin R et al. J Pediatr 2003; 143(6):754–758.
4. Martin R et al. J Hum Lact 2005; 21(1):8–17.
5. Gueimonde M et al. Neonatol 2007; 92(1):64–66.
6. Heikkilä MP, Saris PE). J Appl Microbiol 2003; 95(3):471–478.
7. Kunz C et al. Annu Rev Nutr. 2000; 20:699–722.
8. Gibson CR, Roberfroid MB. J Nutr 1995; 125(6):1401–1412.
